Was ist CRISPR-Genomeditierung und welche Aktien sind am aussichtsreichsten bei der Gentherapie?

Die gentechnische Veränderung von DNA
Die Editierung von Genen bedeutet nichts anderes, als den genetischen Code unserer Gene, die aus doppelsträngiger DNA (Desoxyribonukleinsäure) bestehen, zu verändern. Dabei sind unsere Gene eine individuelle Abfolge von nur vier unterschiedlichen Basen, deren Reihenfolge unter anderem den Code für die Produktion von Proteinen beinhalten.
Diese Basen kürzt man ab mit A, C, G und T, wobei sich im DNA-Doppelstrang immer A und T paaren und C und G (siehe Beispiel Bild 1). Man spricht dann davon, dass A und T wie auch C und G komplementär zueinander sind. Die Pfeile bedeuten, dass beide Stränge antiparallel verlaufen, d. h. in entgegengesetzter Richtung. Gehalten wird das Ganze durch ein Zucker-Phosphat-Rückgrat.

Bild 1: Schematische Darstellung einer DNA
Für die Produktion von Proteinen wird die DNA zunächst zu Einzelsträngen entwirrt. Einer der Einzelstränge wird dann von bestimmten Enzymen (RNA-Polymerasen) abgelesen und damit eine Kopie des Gegenstrangs erzeugt. Eine solche Kopie wird als mRNA (messenger RNA) bezeichnet.
Diese mRNA wandert dann vom Zellkern ins Zytoplasma, wo Ribosomen an sie binden und den genetischen Code ablesen. Die Kombination dreier Basen steht dann jeweils für eine bestimmte Aminosäure. So steht die Basenfolge G-A-C beispielsweise für Asparaginsäure, die man in großer Menge im Spargel (Asparagus) findet. So wird dann Aminosäure an Aminosäure gehängt, bis ein Protein fertig ist.
Die gentechnische Veränderung der reinen DNA außerhalb des Menschen ist recht einfach und führte durch Entdeckung der Restriktionsenzyme 1967 zur Möglichkeit der Klonierung zunächst in Bakterien. Das heißt, man isolierte Bakterien-DNA (Plasmide), veränderte sie und brachte sie zurück in Bakterien. Damit war, wie 1973 erstmals beschrieben, ein gentechnisch veränderter Organismus (GvO) hergestellt worden.
Die Entdeckung der Polymerase-Kettenreaktion (PCR) 1983 machte es dann einfacher, DNA punktgenau zu verändern und zu klonieren, jedoch war die Methode immer noch recht arbeitsintensiv. Und eine Anwendung im Organismus selbst, bei der in vielen Zellen das Erbgut (Genom) gleichzeitig verändert wird, war noch meilenweit entfernt.
10.000 % Rendite und mehr: Das Geheimnis von Amazon & Netflix geknackt!
Bei der Gentherapie zur Heilung von angeborenen Gendefekten ist es aber notwendig, gleichzeitig die DNA vieler Zellen zu korrigieren, um überhaupt einen therapeutischen Effekt zu erzielen. Und dafür gibt es inzwischen viele Methoden, die miteinander konkurrieren.
Gentherapie – Prinzip und Methoden
Als Gentherapie bezeichnet man das Einfügen von DNA in die Körperzellen eines Individuums, um beispielsweise eine Krankheit zu behandeln. Üblicherweise werden dem Körper einige Zellen entnommen, um in diese im Labor (ex vivo) die entsprechende neue DNA einzufügen. Anschließend können die Zellen vermehrt werden, um sie dann wieder in den Körper des Patienten zu bringen. Eine Gentherapie kann prinzipiell auch direkt im Körper (in vivo) erfolgen.
Meistens werden dazu modifizierte Viren als Vektoren (Genfähre) genutzt, da diese leicht zu vervielfältigen sind und ihre DNA einfach gewonnen, verändert und wieder in Viren verpackt werden kann. Zudem übertragen Viren dann hoch effizient die gewünschte neue DNA in die Zielzellen. Alternative chemische und physikalische Methoden sind weit weniger effizient.
Die Genomeditierung ermöglicht heutzutage eine punktgenaue gleichzeitige Veränderung vieler Zellen mit sogenannten Designer-Nukleasen. Dazu zählen Zinkfingernukleasen, TALENs (Transcription Activator-like Effector Nucleases), die CRISPR/Cas9-Methode, das CRISPR/Cpf1-System und Meganukleasen. Die spezifische Erkennung der DNA erfolgt bei der Zinkfingernuklease, der TALEN und der Meganuklease durch einen bestimmten Proteinteil, während sie bei den CRISPR-Systemen durch eine spezifische RNA vermittelt wird.
Während Zinkfingernukleasen und TALEN schon länger etabliert sind, wurde CRISPR erst 2012 entdeckt. CRISPR (engl. Clustered Regularly Interspaced Short Palindromic Repeats) sind Abschnitte sich wiederholender DNA, die man im Erbgut vieler Bakterien findet. Erstaunlich war, dass Bakterien dieses System als eine Art Immunabwehr vor allem gegen Phagen (Bakterienviren) nutzen.
Interessanterweise bauen Bakterien fremde DNA von Phagen ins eigene Erbgut der CRISPR-Bereiche ein. Dieser Bereich wird abgelesen und so ein RNA-Molekül gebildet, das im Zusammenspiel mit verschiedenen Proteinen zukünftig genau diese fremde DNA erkennt. Ein Enzym wie Cas9 zerschneidet dann die fremde DNA, wodurch Phagen nun keine Chance mehr haben, sich in diesen Bakterien zu vermehren.
Diese Vorlage der Natur hat man genutzt, um ein universelles System zu entwickeln, mit dem Gene umgeschrieben (editiert) werden können. Dazu konstruiert man eine geeignete Guide RNA, die der gesuchten DNA-Sequenz entspricht.
Wenn die Guide RNA diese Sequenz gefunden hat, dockt sie dort an, um den DNA-Doppelstrang genau an dieser Stelle mit der gekoppelten Schere Cas9 zu durchschneiden. Das entsprechende Gen kann gezielt in seiner Funktion blockiert werden oder man tauscht einzelne Bausteine aus oder fügt neue Bausteine ein.
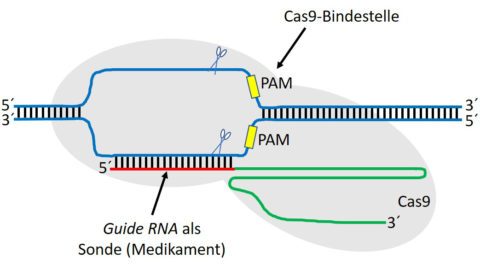
Bild 2: Mechanismus von CRISPR/Cas9
Diese Technologie machen sich Biotechs wie die Schweizer CRISPR Therapeutics (WKN:A2AT0Z), Editas Medicine (WKN:A2AC4K) und Intellia Therapeutics (WKN:A2AG6H) zunutze, um Verfahren zu entwickeln, Erbkrankheiten wie Sichelzellanämie, β-Thalassämie, Duchenne-Muskeldystrophie, Zystische Fibrose oder Hämophilie zu heilen.
Einige ihrer Programme sind ex vivo geplant, bei denen die Erfolgsaussichten ungleich besser sind als in vivo. Das liegt einfach daran, dass die Genomeditierung bei Zellen außerhalb des Patienten einfacher ist als im Patienten selbst. Und zudem gibt es ernsthafte Bedenken, ob CRISPR in vivo überhaupt funktionieren kann.
Fazit
CRISPR-Biotech-Aktien sind hochriskant, da die Technologie brandneu ist und noch keine klinischen Daten vorliegen. Stattdessen gibt es weiter fortgeschrittene Projekte bei Sangamo Therapeutics (WKN:936386), die auf Zinkfingernukleasen setzen, oder CAR-T-Entwickler Cellectis (WKN:A0MKPR), die auf TALEN spezialisiert sind.
Noch weiter sind Biotechs, die Viren für die Gentherapie nutzen, wie beispielsweise Bluebird Bio (WKN:A1W025), UniQure (WKN:A1XDTV) und Spark Therapeutics (WKN:A12HQS). Gerade diese befinden sich auf der Zielgeraden zur Zulassung, und letztlich wird nicht die Methode, sondern der Nutzen für den Patienten über Erfolg und Misserfolg entscheiden.
Denn eins müssen sich Investoren klarmachen: Die CRISPR-Methode ist schnell und einfach und damit erfolgreich in der akademischen Forschung. Zinkfingernukleasen, TALEN und Viren sind aber in der Pharmaindustrie etabliert. Auch wenn sie ein paar Monate länger brauchen, macht das bei zehn Jahren Entwicklungszeit für eine neue Therapie keinen Unterschied.
CRISPR wird sicherlich seinen Platz finden, doch der jetzige Hype um diese Technologie ist meiner Ansicht nach überzogen. Daher denke ich, dass die CRISPR-Blase ähnlich wie die Bitcoin-Blase platzen wird, und diese Technologie danach wieder langsam und gesund wächst.
Nicht zittern – handeln! Der Bärenmarkt-Überlebensguide für Börsenkrisen
Der Aktienmarkt ist derzeit wieder höheren Risiken ausgesetzt. Droht vielleicht sogar ein Bärenmarkt? Vielleicht – aber steck jetzt bloß nicht den Kopf in den Sand!
Wenn die Märkte schwanken und die Nerven flattern – genau dann zählt es, wie du dich als Anleger verhältst. Unser Bärenmarkt-Überlebensguide zeigt dir in vier Schritten, wie du klug, ruhig und strategisch durch jede Korrektur kommst – und sie vielleicht sogar zu deiner größten Chance machst.
Jetzt lesen und vorbereitet sein, wenn andere in Panik verfallen!
Stefan Graupner besitzt keine der erwähnten Aktien. The Motley Fool besitzt und empfiehlt Aktien von Bluebird Bio. The Motley Fool empfiehlt Editas Medicine.
